Bahan aktif: Ceftazidime
Glazidim 250 mg serbuk untuk penyelesaian untuk suntikan
Glazidim 500 mg serbuk untuk penyelesaian untuk suntikan
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan atau infus
Glazidim 2 g serbuk untuk penyelesaian untuk suntikan atau infus
Glazidim 1 g serbuk untuk penyelesaian untuk infusi
Glazidim 2 g serbuk untuk penyelesaian untuk infusi
Mengapa Glazidim digunakan? Untuk apa itu?
Glazidim adalah antibiotik yang digunakan pada orang dewasa dan kanak-kanak (termasuk bayi baru lahir). Ia berfungsi dengan membunuh bakteria yang menyebabkan jangkitan dan tergolong dalam kumpulan ubat yang disebut cephalosporins.
Glazidim digunakan untuk merawat jangkitan bakteria yang teruk:
- paru-paru atau dada
- paru-paru dan bronkus pada pesakit yang menderita fibrosis sista
- otak (meningitis)
- telinga
- saluran kencing
- kulit dan tisu lembut
- dinding perut dan perut (peritonitis)
- tulang dan sendi.
Glazidim juga boleh digunakan:
- untuk mencegah jangkitan semasa pembedahan prostat pada lelaki
- untuk merawat pesakit dengan jumlah sel darah putih rendah (neutropenia) yang mengalami demam akibat 'jangkitan bakteria.
Kontraindikasi Apabila Glazidim tidak boleh digunakan
Anda tidak boleh diberi Gladizim:
- jika anda alah kepada ceftazidime atau mana-mana ramuan lain dari ubat ini (disenaraikan dalam bahagian 6).
- jika anda mempunyai reaksi alergi yang teruk terhadap antibiotik lain (penisilin, monobactams dan carbapenems) kerana anda juga mungkin alah kepada Glazidim.
Beritahu doktor anda sebelum memulakan Glazidim jika anda fikir ini berlaku untuk anda. Anda tidak boleh diberi Glazidim.
Langkah berjaga-jaga untuk penggunaan Apa yang perlu anda ketahui sebelum mengambil Glazidim
Berhati-hati dengan Glazidim
Perhatikan beberapa gejala seperti reaksi alahan, gangguan sistem saraf dan gangguan gastrousus seperti cirit-birit semasa dirawat dengan Glazidim. Ini akan mengurangkan risiko masalah yang mungkin berlaku. Lihat (Keadaan yang perlu anda perhatikan) di bahagian 4. Sekiranya anda mempunyai reaksi alergi terhadap antibiotik lain, anda juga mungkin alah kepada Glazidim.
Sekiranya anda memerlukan ujian darah atau air kencing
Glazidim boleh mempengaruhi keputusan ujian untuk kehadiran gula dalam air kencing dan ujian darah yang dikenali sebagai ujian Coombs. Sekiranya anda menjalani ujian ini:
Beritahu orang yang mengambil sampel bahawa anda sedang dirawat dengan Glazidim.
Interaksi Ubat atau makanan mana yang boleh mengubah kesan Glazidim
Beritahu doktor anda jika anda mengambil, baru-baru ini mengambil atau mungkin mengambil ubat lain. Ini juga termasuk ubat-ubatan tanpa preskripsi.
Anda tidak boleh diberi Glazidim tanpa berunding dengan doktor anda sekiranya anda mengambil:
- antibiotik yang disebut chloramphenicol
- sejenis antibiotik yang disebut aminoglikosida contohnya gentamicin, tobramycin
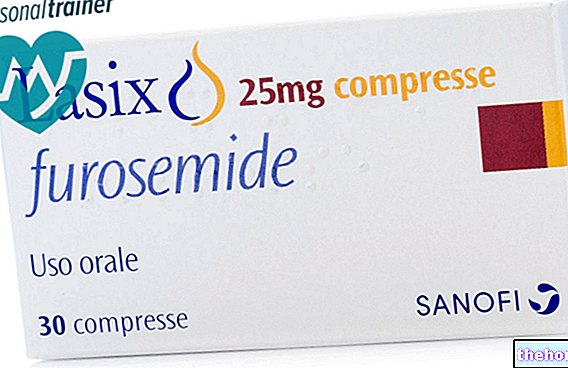
- tablet diuretik yang disebut furosemide
Beritahu doktor anda jika ini berlaku untuk anda.
Amaran Penting untuk mengetahui bahawa:
Kehamilan, penyusuan dan kesuburan
Minta nasihat doktor anda sebelum anda diberi Glazidim:
- jika anda hamil, disyaki atau merancang untuk hamil
- jika anda menyusu
Doktor anda akan mempertimbangkan manfaat rawatan Glazidim berbanding risiko kepada bayi.
Memandu dan menggunakan mesin
Glazidim boleh menyebabkan kesan sampingan yang mempengaruhi kemampuan memandu seperti pening. Jangan memandu atau menggunakan mesin melainkan anda pasti tidak mengalami sebarang kesan.
Glazidim mengandungi natrium
Anda perlu mempertimbangkan perkara berikut sekiranya anda menjalani diet natrium terkawal.
Dos, Kaedah dan Masa Pentadbiran Cara menggunakan Glazidim: Posologi
Bagaimana Glazidim diberikan
Glazidim biasanya diberikan oleh doktor atau jururawat. Ini dapat diberikan sebagai "infus intravena atau sebagai suntikan" secara langsung ke vena atau otot.
Glazidim disediakan oleh doktor, ahli farmasi atau jururawat anda menggunakan air untuk suntikan atau cecair infus yang sesuai.
Dos yang disyorkan
Dos Glazidim yang sesuai akan ditentukan oleh doktor anda dan bergantung kepada: keparahan dan jenis jangkitan; jika anda dirawat dengan antibiotik lain; berat badan dan usia anda, keadaan buah pinggang anda.
Bayi yang baru lahir (0-2 bulan)
Untuk setiap kg berat badan anak, 25 hingga 60 mg Glazidim sehari akan diberikan dalam dua dos yang dibahagi.
Bayi (lebih dari 2 bulan) dan bayi dengan berat kurang dari 40 kg
Untuk setiap kg berat badan bayi atau bayi, 100 hingga 150 mg Glazidim akan diberikan setiap hari dalam tiga dos terbahagi. Dos maksimum ialah 6 g sehari.
Dewasa dan remaja yang beratnya 40 kg atau lebih
1 hingga 2 g Glazidim tiga kali sehari. Dos maksimum ialah 9 g sehari.
Pesakit berumur 65 tahun ke atas
Dos harian pada amnya tidak boleh melebihi 3 g sehari terutama jika anda berumur lebih dari 80 tahun.
Pesakit yang mengalami masalah buah pinggang
Anda mungkin diberi dos yang berbeza daripada biasa. Doktor atau jururawat anda akan menentukan berapa banyak Glazidim yang anda perlukan berdasarkan tahap keparahan penyakit buah pinggang anda. Doktor anda akan memantau anda dengan teliti dan mungkin menjalani ujian fungsi buah pinggang pada selang waktu yang lebih kerap.
Overdosis Apa yang perlu dilakukan sekiranya anda mengambil terlalu banyak Glazidim
Sekiranya anda diberi lebih banyak Glazidim daripada yang sepatutnya
Sekiranya anda tidak sengaja menggunakan dos yang lebih tinggi daripada yang ditetapkan, segera hubungi doktor atau hospital terdekat.
Sekiranya anda terlupa menggunakan Glazidim
Sekiranya anda lupa suntikan, anda mesti meminumnya secepat mungkin.Jangan mengambil dos berganda (dua suntikan pada masa yang sama) untuk menebus dos yang dilupakan, ambil dos seterusnya pada waktu biasa.
Jangan berhenti mengambil Glazidim
Jangan berhenti mengambil Glazidim melainkan jika doktor memberitahu anda. Sekiranya anda mempunyai pertanyaan lebih lanjut mengenai penggunaan ubat ini, tanyakan kepada doktor atau jururawat anda.
Kesan Sampingan Apakah kesan sampingan dari Glazidim
Seperti semua ubat, ubat ini boleh menyebabkan kesan sampingan, walaupun tidak semua orang mendapatnya.
Syarat yang mesti diberi perhatian
Kesan sampingan serius berikut telah berlaku pada sebilangan kecil orang, tetapi kekerapannya tidak diketahui:
- reaksi alahan yang teruk. Tanda-tandanya termasuk ruam gatal, bengkak, kadang-kadang di muka atau mulut menyebabkan kesukaran bernafas.
- ruam dengan formasi lepuh seperti sasaran kecil (tempat gelap di tengah dikelilingi oleh "kawasan cahaya dengan cincin hitam di sekitar pinggir).
- ruam yang meluas dengan lepuh dan mengelupas kulit (ini mungkin merupakan tanda-tanda sindrom Stevens-Johnson atau nekrolisis epidermis toksik).
- gangguan sistem saraf: gegaran, sawan dan, dalam beberapa kes, koma. Ini berlaku pada orang yang dosnya terlalu tinggi, terutama pada orang dengan penyakit ginjal.
Hubungi doktor atau jururawat anda dengan segera sekiranya anda mengalami gejala ini.
Kesan sampingan yang biasa
Ini boleh mempengaruhi sehingga 1 dari 10 pesakit:
- cirit-birit
- bengkak dan kemerahan di sepanjang urat
- timbul ruam merah yang mungkin gatal
- sakit, terbakar, bengkak atau keradangan di tempat suntikan.
Beritahu doktor anda jika ada keadaan yang membimbangkan anda.
Kesan sampingan yang biasa muncul dalam ujian darah adalah:
- peningkatan jenis sel darah putih (eosinofilia)
- peningkatan bilangan sel yang membantu pembekuan darah
- peningkatan enzim hati.
Kesan sampingan yang tidak biasa
Ini boleh mempengaruhi sehingga 1 dari 100 pesakit:
- radang usus yang boleh menyebabkan sakit atau cirit-birit yang mungkin mengandungi darah
- kandidiasis - jangkitan kulat pada mulut atau faraj
- sakit kepala
- pening
- sakit perut
- loya atau muntah
- demam dan menggigil.
Beritahu doktor anda jika anda mempunyai keadaan ini.
Kesan sampingan yang tidak biasa yang mungkin muncul dalam ujian darah adalah:
- pengurangan bilangan sel darah putih
- pengurangan bilangan platelet (sel yang membantu pembekuan darah)
- peningkatan tahap darah urea, BUN atau kreatinin serum.
Kesan sampingan yang sangat jarang berlaku
Ini boleh mempengaruhi sehingga 1 dari 10,000 pesakit:
- Keradangan atau kegagalan buah pinggang
Kesan sampingan yang lain
Kesan sampingan lain telah berlaku pada sebilangan kecil orang, tetapi kekerapannya tidak diketahui:
- rasa jarum dan pin
- rasa tidak sedap di mulut
- menguning putih mata atau kulit.
Kesan sampingan lain yang mungkin muncul dalam ujian darah adalah:
- pemusnahan sel darah merah yang terlalu cepat
- peningkatan dalam beberapa jenis sel darah putih
- penurunan teruk dalam jumlah sel darah putih.
Melaporkan kesan sampingan
Sekiranya anda mendapat kesan sampingan, berbincanglah dengan doktor atau ahli farmasi anda. Ini termasuk kemungkinan kesan sampingan yang tidak disenaraikan dalam risalah ini. Anda juga boleh melaporkan kesan sampingan secara langsung melalui sistem pelaporan di: http://www.agenziafarmaco.gov.it/it/responsabili. Dengan melaporkan kesan sampingan, anda dapat membantu memberikan lebih banyak maklumat mengenai keselamatan ubat ini.
Tamat Tempoh dan Pengekalan
Jauhkan ubat ini dari pandangan dan jangkauan kanak-kanak.
Sebelum penggabungan semula, simpan botol yang dilindungi dari cahaya.
Produk dalam larutan, selepas penggantian semula dengan air p.p.i. o dengan cecair infus yang serasi (misalnya larutan garam, glukosa atau natrium laktat) biasanya harus digunakan dalam masa 18 jam jika disimpan pada suhu biasa dan dalam masa 7 hari jika disimpan pada suhu 4 ° C.
Bentuk komposisi dan farmaseutikal
Apa yang mengandungi Glazidim
Bahan aktif adalah ceftazidime (sebagai ceftazidime pentahydrate).
Glazidim 250 mg serbuk untuk penyelesaian untuk suntikan mengandungi 250 mg ceftazidime
Glazidim 500 mg serbuk untuk penyelesaian untuk suntikan mengandungi 500 mg ceftazidime
Glazidim 1 g serbuk untuk larutan suntikan mengandungi 1 g ceftazidime
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan atau infusi mengandungi 1 g ceftazidime
Glazidim 2 g serbuk untuk penyelesaian untuk suntikan atau infusi mengandungi 2 g ceftazidime
Glazidim 1 g serbuk untuk penyelesaian untuk infusi mengandungi 1 g ceftazidime
Glazidim 2 g serbuk untuk penyelesaian untuk infusi mengandungi 2 g ceftazidime
Eksipien adalah:
Botol serbuk: natrium karbonat anhidrat.
Ampul pelarut: air untuk suntikan.
Beg infusi mengandungi:
natrium klorida
air untuk suntikan
Seperti apa Glazidim dan kandungan peknya
Glazidim dibungkus dalam botol kaca tanpa warna jenis III dengan penutup elastomer dan penutup aluminium; pelarut dalam botol kaca tanpa warna jenis I.
Glazidim 250 mg serbuk untuk penyelesaian untuk suntikan:
- 1 botol serbuk + ampul pelarut 1 ml
Glazidim 500 mg serbuk untuk penyelesaian untuk suntikan:
- 1 botol serbuk + ampul pelarut 1.5 ml
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan:
- 1 botol serbuk + ampul pelarut 3 ml
- 1 botol serbuk + ampul pelarut 10 ml
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan atau infus:
- 10 botol serbuk
- 25 botol serbuk
Glazidim 2 g serbuk untuk suntikan untuk penyelesaian untuk infus:
- 1 botol serbuk
Glazidim 1 g dan 2 g serbuk untuk penyelesaian untuk infusi dibungkus dalam botol kaca berwarna I yang dilengkapi dengan alat yang dipatenkan khas - MONOVIAL - untuk penyediaan penyelesaian infusi. Beg infusi yang mengandungi larutan fisiologi mempunyai kapasiti 100 ml.
Glazidim 1 g serbuk untuk penyelesaian untuk infus:
- 1 botol serbuk dengan peranti MONOVIAL
- 1 botol serbuk dengan alat MONOVIAL + beg infusi 100 ml.
Glazidim 2 g serbuk untuk penyelesaian untuk infus:
- 1 botol serbuk dengan peranti MONOVIAL
- 1 botol serbuk dengan alat MONOVIAL + beg infusi 100 ml.
Risalah Pakej Sumber: AIFA (Badan Perubatan Itali). Kandungan yang diterbitkan pada Januari 2016. Maklumat yang ada mungkin tidak terkini.
Untuk mempunyai akses ke versi paling terkini, disarankan untuk mengakses laman web AIFA (Badan Perubatan Itali). Penafian dan maklumat berguna.
01.0 NAMA PRODUK PERUBATAN
GLAZIDIM
02.0 KOMPOSISI KUALITATIF DAN KUANTITATIF
Glazidim 250 mg serbuk untuk penyelesaian untuk suntikan
Setiap botol mengandungi 250 mg ceftazidime (sebagai ceftazidime pentahydrate)
Glazidim 500 mg serbuk untuk penyelesaian untuk suntikan
Setiap botol mengandungi 500 mg ceftazidime (sebagai ceftazidime pentahydrate)
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan
Setiap botol mengandungi 1 g ceftazidime (sebagai ceftazidime pentahydrate)
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan atau infus
Setiap botol mengandungi 1 g ceftazidime (sebagai ceftazidime pentahydrate)
Glazidim 2 g serbuk untuk penyelesaian untuk suntikan atau infus
Setiap botol mengandungi 2 g ceftazidime (sebagai ceftazidime pentahydrate)
Glazidim 1 g serbuk untuk penyelesaian untuk infusi
Setiap botol mengandungi 1 g ceftazidime (sebagai ceftazidime pentahydrate)
Glazidim 2 g serbuk untuk penyelesaian untuk infusi
Setiap botol mengandungi 2 g ceftazidime (sebagai ceftazidime pentahydrate)
Untuk senarai lengkap eksipien, lihat bahagian 6.1.
03.0 BORANG FARMASI
250 mg, 500 mg 1 g serbuk untuk penyelesaian untuk suntikan
Serbuk untuk larutan untuk suntikan
1 g, 2 g serbuk untuk penyelesaian untuk suntikan atau infus
Serbuk untuk penyelesaian untuk suntikan atau infusi
1 g, 2 g serbuk untuk penyelesaian untuk infusi (dengan peranti Monovial)
Serbuk untuk larutan untuk infusi
04.0 MAKLUMAT KLINIKAL
04.1 Petunjuk terapeutik
Glazidim ditunjukkan untuk rawatan jangkitan yang disenaraikan di bawah ini pada orang dewasa dan kanak-kanak termasuk neonatus (sejak lahir).
• Pneumonia nosokomial
• Jangkitan bronkopulmonari pada fibrosis sista
• Meningitis bakteria
• Otitis media supuratif kronik
• Otitis luaran malignan
• Komplikasi jangkitan saluran kencing
• Komplikasi jangkitan pada kulit dan tisu lembut
• Komplikasi jangkitan intra-perut
• Jangkitan tulang dan sendi
• Peritonitis berkaitan dialisis pada pesakit dengan dialisis peritoneal ambulatori berterusan (Dialisis peritoneal ambulatori berterusan-CAPD).
Rawatan pesakit dengan bakteria yang berlaku atau disyaki berkaitan dengan mana-mana jangkitan yang disenaraikan di atas.
Ceftazidime dapat digunakan dalam pengelolaan pesakit neutropenik dengan demam yang disyaki disebabkan oleh "jangkitan bakteria."
Ceftazidime boleh digunakan dalam profilaksis peri-operasi jangkitan saluran kencing pesakit yang menjalani reseksi trans-uretra prostat (reseksi trans-uretra prostat-TURP).
Pilihan ceftazidime mesti mengambil kira spektrum antibakteria yang terhad terutamanya kepada bakteria aerobik Gram negatif (lihat bahagian 4.4 dan 5.1).
Ceftazidime mesti diberikan bersama-sama dengan agen antibakteria lain apabila bakteria yang dianggap berpotensi bertanggungjawab terhadap jangkitan berada di luar spektrum aktivitinya.
Garis panduan rasmi mengenai penggunaan agen antibakteria yang sesuai harus dipertimbangkan.
04.2 Posologi dan kaedah pentadbiran
Dos
Jadual 1: dewasa dan kanak-kanak ≥ 40 kg
Jadual 2: kanak-kanak
Populasi kanak-kanak
Keselamatan dan keberkesanan Glazidim yang diberikan sebagai infus berterusan pada bayi dan kanak-kanak berumur ≤ 2 bulan belum dapat dipastikan.
Warga emas
Memandangkan pengurangan ceftazidime yang berkaitan dengan usia pada pesakit tua, dos harian biasanya tidak melebihi 3 g pada pesakit yang berusia lebih dari 80 tahun.
Kerosakan hepatik
Data yang tersedia tidak menunjukkan perlunya penyesuaian dos bagi pesakit dengan gangguan hepatik ringan atau sederhana. Tidak ada data dari kajian pada pesakit dengan gangguan hati yang teruk (lihat juga bahagian 5.2). Pemantauan klinikal yang dekat untuk keselamatan dan keberkesanan dinasihatkan.
Kerosakan buah pinggang
Ceftazidime diekskresikan tidak berubah oleh buah pinggang. Oleh itu, pada pesakit dengan fungsi ginjal yang terganggu, dosnya harus dikurangkan (lihat juga bahagian 4.4).
Dos pemuatan awal 1 g harus diberikan. Dos penyelenggaraan harus berdasarkan pelepasan kreatinin.
Jadual 3: Dos penyelenggaraan Glazidim yang disyorkan dalam gangguan buah pinggang "." infusi sekejap-sekejap
Orang dewasa dan kanak-kanak ≥ 40 kg
Pada pesakit dengan jangkitan teruk, dos unit harus ditingkatkan sebanyak 50% atau kekerapan dos harus ditingkatkan.
Pada kanak-kanak, anggaran pelepasan kreatinin harus dikira sebagai fungsi luas permukaan badan atau jisim badan tanpa lemak.
Anak-anak
Pemantauan klinikal yang dekat untuk keselamatan dan keberkesanan dinasihatkan.
Jadual 4: Dos penyelenggaraan Glazidim yang disarankan dalam gangguan buah pinggang "." infusi berterusan
Dewasa dan kanak-kanak ≥ 40 kg
Perhatian disarankan dalam pemilihan dos. Pemantauan klinikal yang dekat untuk keselamatan dan keberkesanan dinasihatkan.
Anak-anak
Keselamatan dan keberkesanan Glazidim diberikan sebagai infusi berterusan pada kanak-kanak dengan penurunan berat badan buah pinggang
Sekiranya infusi berterusan digunakan pada kanak-kanak dengan gangguan ginjal, pelepasan kreatinin harus dikira sebagai fungsi luas permukaan badan atau jisim badan tanpa lemak.
Hemodialisis
Nilai separuh hayat serum semasa hemodialisis berkisar antara 3 hingga 5 jam.
Selepas setiap tempoh hemodialisis, dos pemeliharaan ceftazidime yang disyorkan dalam Jadual 5 dan 6 harus diulang.
Dialisis peritoneal
Ceftazidime boleh digunakan dalam dialisis peritoneal dan dialisis peritoneal ambulatori berterusan (CAPD).
Selain penggunaan intravena, ceftazidime dapat ditambahkan ke cairan dialisis (biasanya 125 hingga 250 mg per 2 liter larutan dialisis).
Bagi pesakit dengan kekurangan buah pinggang pada hemodialisis arteriovenous berterusan atau hemofiltrasi aliran tinggi di unit rawatan intensif: 1 g sehari sama ada dalam dos tunggal atau dalam dos terbahagi. Untuk hemofiltrasi aliran rendah ikuti dos yang disyorkan dalam gangguan buah pinggang.
Bagi pesakit dalam hemofiltrasi veno-venous dan hemodialisis veno-venous, ikuti dos yang disyorkan dalam Jadual 5 dan 6 di bawah.
Jadual 5: Garis panduan dos hemofiltrasi veno-vena berterusan
Jadual 6: Garis panduan dos hemodialisis vena-vena berterusan
Kaedah pentadbiran
Dos bergantung kepada keparahan, kepekaan, lokasi dan jenis jangkitan dan usia dan fungsi ginjal pesakit.
Glazidim 500 mg dan 250 mg harus diberikan dengan suntikan intravena atau dengan suntikan intramuskular mendalam. Tempat suntikan intramuskular yang disyorkan adalah kuadran atas luar gluteus maximus atau bahagian pangkal paha. Penyelesaian glazidim boleh diberikan terus ke urat. Kaedah pentadbiran yang disyorkan standard adalah dengan suntikan intravena sekejap-sekejap. Pentadbiran intramuskular hanya perlu dipertimbangkan apabila jalan pemberian intravena tidak mungkin atau kurang sesuai untuk pesakit.
Glazidim 1 g harus diberikan dengan suntikan intravena atau dengan infus atau dengan suntikan intramuskular mendalam. Tempat suntikan intramuskular yang disyorkan adalah kuadran atas luar gluteus maximus atau bahagian pangkal paha. Penyelesaian glazidim dapat diberikan secara langsung ke vena atau diperkenalkan melalui set infus jika pesakit menerima cairan secara parenteral. Kaedah pentadbiran yang disyorkan standard adalah dengan suntikan intravena sekejap-sekejap atau infus intravena berterusan. Pentadbiran intramuskular hanya perlu dipertimbangkan apabila jalan pemberian intravena tidak mungkin atau kurang sesuai untuk pesakit.
Glazidim 2 g harus diberikan dengan suntikan atau infus intravena.Penyelesaian glazidim dapat diberikan secara langsung ke vena atau diperkenalkan melalui set infus jika pesakit menerima cairan secara parenteral. Kaedah pentadbiran yang disyorkan standard adalah dengan suntikan intravena sekejap-sekejap atau infus intravena berterusan.
04.3 Kontraindikasi
Hipersensitiviti terhadap ceftazidime, kepada cephalosporin lain atau kepada mana-mana eksipien yang disenaraikan dalam bahagian 6.1.
Sejarah hipersensitiviti teruk (mis. Reaksi anafilaksis) terhadap jenis agen antibakteria beta-laktam lain (penisilin, monobactams dan carbapenems).
04.4 Amaran khas dan langkah berjaga-jaga yang sesuai untuk digunakan
Seperti semua agen antibakteria beta-laktam, reaksi hipersensitiviti yang teruk dan kadang-kadang membawa maut. Sekiranya terdapat reaksi hipersensitiviti yang teruk, rawatan dengan ceftazidime harus dihentikan segera dan langkah-langkah kecemasan yang sesuai akan dilaksanakan.
Sebelum memulakan rawatan, perlu dipastikan bahawa pesakit tidak mempunyai riwayat reaksi hipersensitiviti yang teruk terhadap ceftazidime atau cephalosporins lain atau jenis agen beta-laktam yang lain. Perhatian khusus harus diberikan sekiranya ceftazidime diberikan kepada pesakit yang mempunyai "riwayat" hipersensitiviti tidak teruk terhadap agen beta-laktam lain.
Ceftazidime mempunyai spektrum aktiviti antibakteria yang terhad. Ia tidak sesuai digunakan sebagai agen antibakteria tunggal untuk rawatan jenis jangkitan tertentu kecuali jika patogen sudah didokumentasikan dan diketahui sensitif atau terdapat kecurigaan tinggi bahawa patogen yang paling mungkin sensitif. berlaku terutamanya ketika mempertimbangkan rawatan pesakit dengan bakteria dan ketika merawat meningitis bakteria, jangkitan kulit dan tisu lembut, dan jangkitan tulang dan sendi. Selanjutnya, ceftazidime sensitif terhadap hidrolisis beberapa laktamase beta spektrum luas (beta-laktamase spektrum lanjutan-ESBL). Oleh itu, maklumat mengenai kelaziman organisma penghasil ESBL harus dipertimbangkan ketika memilih rawatan ceftazidine.
Kolitis yang berkaitan dengan agen antibakteria dan kolitis pseudo-membranous telah dilaporkan dengan hampir semua agen antibakteria, termasuk ceftazidime dan dapat berkisar dari keparahan dari ringan hingga mengancam nyawa. Oleh itu, adalah penting untuk mempertimbangkan diagnosis ini pada pesakit yang mengalami cirit-birit semasa atau selepas pentadbiran ceftazidime (lihat bahagian 4.8). Penghentian terapi ceftazidime dan pemberian rawatan khusus untuk Clostridium difficile mesti diambil kira. Produk ubat yang menghalang peristalsis tidak boleh diberikan.
Rawatan bersamaan dengan dos tinggi cephalosporins dan produk ubat nefrotoksik seperti aminoglikosida atau diuretik yang kuat (mis. Furosemide) boleh memberi kesan buruk terhadap fungsi ginjal.
Ceftazidime dihilangkan oleh buah pinggang, oleh itu dos harus dikurangkan mengikut tahap gangguan buah pinggang. Pesakit dengan gangguan ginjal harus dipantau dengan teliti untuk keberkesanan dan keselamatannya. Sekuel neurologi kadang-kadang dilaporkan ketika dosnya belum dikurangkan pada pasien dengan gangguan ginjal (lihat bahagian 4.2 dan 4.8).
Penggunaan yang berpanjangan boleh menyebabkan pertumbuhan mikroorganisma yang tidak sensitif (misalnya Enterococci, fungi) yang mungkin memerlukan penghentian rawatan atau langkah-langkah lain yang sesuai. Pemantauan berulang kali terhadap keadaan pesakit adalah mustahak.
Ceftazidime tidak mengganggu ujian enzimatik untuk penentuan glikosuria, tetapi sedikit gangguan (positif-palsu) mungkin berlaku dengan kaedah berdasarkan pengurangan tembaga (Benedict, Fehling, Clinitest).
Ceftazidime tidak mengganggu ujian picrate alkali untuk penentuan kreatinin.
Perkembangan ujian Coombs positif yang berkaitan dengan penggunaan ceftazidime pada kira-kira 5% pesakit boleh mengganggu ujian keserasian darah.
Maklumat penting mengenai eksipien Glazidim:
250 mg serbuk untuk penyelesaian untuk suntikan
Glazidim 250 mg mengandungi 13 mg natrium setiap botol.
500 mg serbuk untuk penyelesaian untuk suntikan
Glazidim 500 mg mengandungi 26 mg natrium setiap botol.
1 g serbuk untuk penyelesaian untuk suntikan atau infus, 1 g serbuk untuk penyelesaian untuk infus
Glazidim 1 g mengandungi 52 mg natrium setiap botol.
2 g serbuk untuk penyelesaian untuk suntikan atau infus, 2 g serbuk untuk larutan untuk infus
Glazidim 2 g mengandungi 104 mg natrium setiap botol.
Ini harus dipertimbangkan untuk pesakit yang menjalani diet natrium terkawal.
04.5 Interaksi dengan produk ubat lain dan bentuk interaksi lain
Hanya kajian interaksi dengan probenecid dan furosemide yang telah dilakukan.
Penggunaan dosis tinggi bersamaan dengan produk ubat nefrotoksik boleh memberi kesan buruk terhadap fungsi ginjal (lihat bahagian 4.4).
Chloramphenicol adalah antagonis secara in vitro ceftazidime dan cephalosporins lain. Kesesuaian klinikal pemerhatian ini tidak diketahui, tetapi jika dicadangkan penggunaan ceftazidime dan kloramfenikol, kemungkinan pertentangan antara kedua antibiotik harus dipertimbangkan.
04.6 Kehamilan dan penyusuan
Kehamilan
Terdapat sebilangan besar data mengenai penggunaan ceftazidime pada wanita hamil. Kajian pada haiwan tidak menunjukkan kesan berbahaya langsung atau tidak langsung terhadap kehamilan, perkembangan embrio / janin, kelahiran atau kelahiran selepas kelahiran (lihat bahagian 5.3).
Glazidim hanya boleh diresepkan kepada wanita hamil jika manfaatnya melebihi risiko.
Kehamilan
Ceftazidime diekskresikan dalam susu ibu dalam jumlah kecil tetapi pada dos terapi ceftazidime tidak dijangka kesan pada bayi yang disusui. Ceftazidime boleh digunakan semasa menyusu.
Kesuburan
Data tidak ada.
04.7 Kesan terhadap kemampuan memandu dan menggunakan mesin
Tidak ada kajian mengenai kemampuan memandu dan menggunakan mesin. Walau bagaimanapun, kesan yang tidak diingini (seperti pening) mungkin berlaku yang boleh menjejaskan kemampuan memandu atau menggunakan mesin (lihat bahagian 4.8).
04.8 Kesan yang tidak diingini
Reaksi buruk yang paling biasa adalah eosinofilia, trombositosis, phlebitis atau thrombophlebitis dengan pemberian intravena, cirit-birit, peningkatan sementara dalam enzim hati, ruam makulopapular atau urtikaria, sakit dan / atau keradangan berikutan suntikan intramuskular, dan ujian Coombs positif.
Data dari ujian klinikal yang ditaja dan tidak ditaja digunakan untuk menentukan kekerapan kesan sampingan yang biasa dan tidak biasa. Kekerapan yang diberikan kepada semua kesan yang tidak diingini ditentukan terutamanya berdasarkan data farmakovigilance berikutnya
pemasaran dan merujuk kepada kekerapan pelaporan dan bukannya kekerapan sebenar.Dalam setiap kelas frekuensi, kesan yang tidak diingini disenaraikan mengikut urutan penurunan. Konvensyen berikut digunakan untuk klasifikasi frekuensi:
Sangat biasa (≥ 1/10)
Biasa (≥1 / 100 y
Tidak biasa (≥1 / 1000 y
Jarang (≥1 / 10,000 y
Sangat jarang (
Tidak diketahui (tidak dapat dianggarkan dari data yang ada)
1 Terdapat laporan sekuel neurologi termasuk gegaran, mioklonus, sawan, ensefalopati dan koma pada pesakit dengan gangguan ginjal yang mana dos Glazidim tidak dikurangkan dengan tepat.
2 Cirit-birit dan kolitis boleh dikaitkan dengan kehadiran Clostridium difficile dan terdapat dalam bentuk kolitis pseudomembranous.
3 ALT (SGPT), AST (SOGT), LHD, GGT, alkali fosfatase.
4 Ujian positif Coombs berkembang pada kira-kira 5% pesakit dan boleh mengganggu ujian keserasian darah.
Melaporkan tindak balas buruk yang disyaki
Pelaporan tindak balas buruk yang disyaki berlaku setelah kebenaran produk ubat adalah penting kerana ia memungkinkan pemantauan berterusan terhadap keseimbangan manfaat / risiko produk ubat tersebut. Profesional penjagaan kesihatan diminta untuk melaporkan sebarang reaksi buruk yang disyaki melalui sistem pelaporan nasional. "Alamat: http : //www.agenziafarmaco.gov.it/it/responsabili.
04.9 Overdosis
Overdosis boleh menyebabkan sekuel neurologi termasuk ensefalopati, sawan dan koma.
Gejala overdosis mungkin berlaku jika dos tidak dikurangkan dengan tepat pada pesakit dengan gangguan ginjal (lihat bahagian 4.2 dan 4.4).
Tahap serum ceftazidime dapat dikurangkan dengan hemodialisis atau dialisis peritoneal.
05.0 HARTA FARMAKOLOGI
05.1 Sifat farmakodinamik
Kumpulan farmakoterapeutik: Antibakteria untuk penggunaan sistemik. Cephalosporins generasi ketiga - Kod ATC: J01DD02.
Mekanisme tindakan
Ceftazidime menghalang sintesis dinding sel bakteria berikutan melekat pada protein pengikat penisilin (protein pengikat penisilin - PBP). Ini melibatkan gangguan biosintesis dinding sel (peptidoglycan) yang menyebabkan lisis dan kematian sel bakteria.
Hubungan farmakokinetik / farmakodinamik
Untuk cephalosporins, indeks farmakokinetik-farmakodinamik yang paling penting berkorelasi dengan keberkesanan dalam vivo telah terbukti sebagai peratusan masa dalam julat dos di mana kepekatan ubat tanpa protein tetap melebihi kepekatan perencatan minimum (MIC) ceftazidime untuk spesies bakteria sasaran individu (iaitu T%> MIC).
Mekanisme rintangan
Ketahanan bakteria terhadap ceftazidime mungkin disebabkan oleh satu atau lebih mekanisme berikut:
• hidrolisis oleh beta laktamase. Ceftazidime dapat dihidrolisis secara berkesan oleh beta-laktamase spektrum luas (beta-laktamase spektrum lanjutan-ESBL) termasuk keluarga SHV ESBL dan enzim AmpC yang boleh disebabkan atau ditindas secara stabil pada beberapa spesies bakteria Gram-negatif aerobik
• mengurangkan pertalian protein pengikat penisilin untuk ceftazidime
• ketelapan membran luar yang membatasi akses ceftazidime ke protein pengikat penisilin dalam organisma Gram-negatif
• pam efflux bakteria.
Titik putus
Titik penembusan Minimum Inhibitory Concentration (MIC) yang ditubuhkan oleh Jawatankuasa Eropah untuk Ujian Sensitiviti Antibakteria (Jawatankuasa Eropah mengenai Ujian Kerentanan Antimikrob - EUCAST) adalah berikut:
S = sensitif, I = pertengahan, R = tahan.
1 Titik putus hubungan dengan terapi dos tinggi (2 g x 3).
2 Titik pemisah yang berkaitan dengan spesies kebanyakannya ditentukan berdasarkan data PK / PD dan tidak bergantung pada taburan spesies spesifik MIC. Mereka hanya untuk spesies yang tidak disebutkan dalam jadual atau nota di bawah.
Kepekaan mikrobiologi
Kelaziman rintangan yang diperoleh mungkin berbeza-beza secara geografi dan mengikut masa untuk spesies yang dipilih, dan maklumat tempatan mengenai ketahanan sangat diperlukan, terutama ketika merawat jangkitan yang teruk. Sekiranya perlu, apabila prevalensi ketahanan tempatan sedemikian rupa sehingga kegunaan ceftazidime dalam beberapa jenis jangkitan dipertanyakan, nasihat pakar harus dicari.
biri-biri yang sensitif
Aerob gram positif:
Streptococcus pyogenes
Streptococcus agalactiae
Aerob gram negatif:
Citrobacter koseri
Haemophilus influenzae
Moraxella catarrhalis
Neisseria meningitidis
Pasteurella multocida
Proteus mirabilis
Proteus spp. (yang lain)
Providencia spp.
Spesies yang mempunyai stamina yang diperoleh boleh menjadi masalah
Aerob gram negatif:
Acinetobacter baumannii £ +
Burkholderia cepacia
Citrobacter freundii
Enterobacter aerogenes
Enterobacter cloacae
Escherichia coli
Klebsiella pneumoniae
Klebsiella spp. (yang lain)
Pseudomonas aeruginosa
Serratia spp.
Morganella morganii
Aerob gram positif:
Staphylococcus aureus £
Streptococcus pneumoniae £ £
Viridans kumpulan streptokokus
Anaerob positif gram:
Clostridium perfringens
Peptostreptococcus spp.
Anaerob gram negatif:
Fusobacterium spp.
Organisma yang tahan secara melekat
Aerob gram positif:
Enterococcus spp. termasuk Enterococcus faecalis dan Enterococcus faecium
Listeria spp.
Anaerob positif gram:
Clostridium difficile
Anaerob gram negatif:
Bakteroid spp. (banyak spesies Bacteroides fragilis tahan).
Lain-lain:
Chlamydia spp.
Mycoplasma spp.
Legionella spp.
£ S. aureus yang sensitif terhadap metisilin dianggap mempunyai kepekaan rendah pada ceftazidime. Semua S. aureus tahan methicillin tahan terhadap ceftazidime.
££ S. pneumoniae menunjukkan kerentanan menengah atau tahan terhadap penisilin diharapkan dapat menunjukkan kerentanan sekurang-kurangnya dikurangkan terhadap ceftazidime.
+Kadar rintangan yang tinggi telah diperhatikan di satu atau lebih kawasan / negara / wilayah dalam Kesatuan Eropah.
05.2 Sifat farmakokinetik
Penyerapan
Selepas pemberian intramuskular 500 mg dan 1 g ceftazidime, tahap plasma puncak masing-masing 18 dan 37 mg / l, dicapai dengan cepat. Lima minit selepas pemberian bolus intravena 500 mg, 1 g atau 2 g, tahap plasma masing-masing adalah 46, 87 dan 170 mg / l. Kinetik ceftazidime adalah linear dalam julat dos tunggal 0,5 hingga 2 g berikutan pemberian intravena atau intramuskular.
Pembahagian
Pengikatan protein serum ceftazidime rendah dan kira-kira 10%. Kepekatan melebihi MIC untuk patogen biasa boleh diperolehi dalam tisu seperti tulang, jantung, hempedu, dahak, humor berair, sinovial, pleura dan cairan peritoneal. Ceftazidime cepat melintasi plasenta dan dikeluarkan dalam susu ibu. Penembusan ke dalam darah utuh penghalang otak kurang baik, menyebabkan tahap ceftazidime rendah dalam CSF sekiranya tidak ada keradangan.Namun, kepekatan 4 hingga 20 mg / l atau lebih banyak dijumpai di CSF ketika meninges meradang.
Biotransformasi
Ceftazidime tidak dimetabolisme.
Penghapusan
Selepas pemberian parenteral, kadar plasma menurun dengan waktu paruh sekitar 2 jam. Ceftazidime diekskresikan tidak berubah dalam air kencing dengan penyaringan glomerular. Kira-kira 80-90% dos pulih dalam air kencing dalam 24 jam. Kurang dari 1% diekskresikan melalui hempedu.
Populasi pesakit khas
Kerosakan buah pinggang
Penghapusan ceftazidime menurun pada pesakit dengan fungsi ginjal yang terganggu dan dosnya harus dikurangkan (lihat bahagian 4.2).
Kerosakan hepatik
Kehadiran disfungsi hepatik ringan hingga sederhana tidak mempengaruhi farmakokinetik ceftazidime dalam dos individu 2 g intravena setiap 8 jam selama 5 hari dengan syarat fungsi ginjal tidak terganggu (lihat bahagian 4.2).
Warga emas
Penurunan pelepasan yang diperhatikan pada pesakit tua terutamanya disebabkan oleh penurunan umur pelepasan ceftazidime yang berkaitan dengan usia. Waktu paruh penghapusan min berkisar antara 3,5 hingga 4 jam setelah dos tunggal atau berulang selama 7 hari dua kali sehari. 2 g dengan suntikan bolus intravena pada pesakit tua yang berumur 80 tahun ke atas.
Populasi kanak-kanak
Separuh hayat ceftazidime berpanjangan pada bayi prematur dan bayi penuh dari 4.5 hingga 7.5 jam selepas dos 25 hingga 30 mg / kg. Walau bagaimanapun, pada usia 2 bulan, separuh hayat adalah dalam nilai bagi orang dewasa .
05.3 Data keselamatan praklinikal
Data bukan klinikal tidak menunjukkan bahaya khusus bagi manusia berdasarkan kajian konvensional mengenai farmakologi keselamatan, ketoksikan dos berulang, ketoksikan genotik, ketoksikan pembiakan. Kajian karsinogenisiti belum dijalankan dengan ceftazidime.
06.0 MAKLUMAT FARMASI
06.1 Eksipien
Botol serbuk: natrium karbonat anhidrat.
Ampul pelarut: air untuk suntikan.
Beg infusi mengandungi:
natrium klorida
air untuk suntikan
06.2 Ketidaksesuaian
Ceftazidime dapat dicairkan dalam cecair infus biasa, kecuali larutan natrium bikarbonat di mana ia kurang stabil. Selanjutnya, ceftazidime tidak boleh dicampurkan dalam set infus atau picagari yang sama dengan aminoglikosida.
Pembentukan endapan telah dilaporkan dengan menambahkan vancomycin ke larutan ceftazidime. Sekiranya diperlukan untuk pemberian kedua antibiotik ini secara berurutan, disarankan untuk mengalirkan sejumlah cairan infus yang cukup, untuk mendapatkan pencucian set infus yang mencukupi, antara kedua-dua pemberian.
06.3 Tempoh sah
2 tahun
06.4 Langkah berjaga-jaga khas untuk penyimpanan
Sebelum penggabungan semula, simpan botol yang dilindungi dari cahaya.
Produk dalam larutan, selepas penggantian semula dengan air p.p.i. o dengan cecair infus yang serasi (contohnya larutan garam, glukosa atau natrium laktat) biasanya harus digunakan dalam masa 18 jam jika disimpan pada suhu biasa dan dalam masa 7 hari jika disimpan pada suhu 4 ° C.
06.5 Sifat pembungkusan segera dan kandungan bungkusan
Glazidim 250 mg serbuk untuk penyelesaian untuk suntikan:
• 1 botol serbuk + 1 ml ampul pelarut
Glazidim 500 mg serbuk untuk penyelesaian untuk suntikan:
• 1 botol serbuk + ampul pelarut 1.5 ml
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan:
• 1 botol serbuk + ampul pelarut 3 ml
• 1 botol serbuk + ampul pelarut 10 ml
Glazidim 1 g serbuk untuk penyelesaian untuk suntikan atau infus:
• 10 botol serbuk
• 25 botol serbuk
Glazidim 2 g serbuk untuk penyelesaian untuk suntikan atau infus:
• 1 botol serbuk
Glazidim dibungkus dalam botol kaca tanpa warna jenis III dengan penutup elastomer dan penutup aluminium; pelarut dalam botol kaca tanpa warna jenis I.
Glazidim 1 g serbuk untuk penyelesaian untuk infus:
• 1 botol serbuk dengan peranti MONOVIAL
• 1 botol serbuk dengan peranti MONOVIAL + beg infusi 100 ml.
Glazidim 2 g serbuk untuk penyelesaian untuk infus:
• 1 botol serbuk dengan peranti MONOVIAL
• 1 botol serbuk dengan peranti MONOVIAL + beg infusi 100 ml.
Glazidim 1 g dan 2 g serbuk untuk penyelesaian untuk infusi dibungkus dalam botol kaca berwarna I yang dilengkapi dengan alat yang dipatenkan khas - MONOVIAL - untuk penyediaan penyelesaian infusi. Beg infusi yang mengandungi larutan fisiologi mempunyai kapasiti 100 ml.
06.6 Arahan penggunaan dan pengendalian
Semua jenis botol Glazidim dibekalkan dalam tekanan yang berkurang. Semasa produk larut, karbon dioksida dilepaskan dan tekanan positif berkembang. Gelembung kecil karbon dioksida dalam larutan yang disusun semula dapat diabaikan.
Arahan untuk penggabungan semula
Lihat jadual untuk penambahan isi padu larutan dan kepekatan yang mungkin berguna sekiranya dos pecahan diperlukan.
* Catatan: Penambahan mesti dilakukan dalam dua langkah.
Warna larutan boleh berbeza-beza dari kuning pucat hingga ambar bergantung pada kepekatan, jenis pencairan dan keadaan penyimpanan yang digunakan. Dalam kerangka cadangan yang ditetapkan, aktiviti produk tidak dipengaruhi oleh variasi warna tersebut.
Ceftazidime pada kepekatan antara 1 mg / ml dan 40 mg / ml serasi dengan:
• natrium klorida 9 mg / ml (0.9%) untuk suntikan
• sodium laktat M / 6 untuk suntikan
• sebatian natrium laktat untuk suntikan (larutan Hartmann)
• 5% dekstrosa untuk suntikan
• 0.225% sodium chloride dan 5% dextrose untuk suntikan
• 0,45% natrium klorida dan 5% dekstrosa untuk suntikan
• 0,9% natrium klorida dan 5% dekstrosa untuk suntikan
• 0.18% natrium klorida dan 4% dekstrosa untuk suntikan
• 10% dekstrosa untuk suntikan
• Dextran 40 10% untuk suntikan dalam 0,9% sodium chloride untuk suntikan
• Dextran 40 10% untuk suntikan dalam 5% dekstrosa untuk suntikan
• Dextran 70 6% untuk suntikan dalam 0,9% sodium chloride untuk suntikan
• Dextran 70 6% untuk suntikan dalam dekstrosa 5% untuk suntikan
Ceftazidime pada kepekatan antara 0,05 mg / ml dan 0,25 mg / ml serasi dengan larutan laktat untuk dialisis intra-peritoneal.
Ceftazidime boleh disusun semula untuk penggunaan intramuskular dengan 0.5% atau 1% lidocaine hidroklorida untuk suntikan.
Kandungan botol ceftazidime 500 mg untuk suntikan, disusun semula dengan 1.5 ml air untuk suntikan, dapat ditambahkan ke larutan metronidazole (500 mg dalam 100 ml) dan kedua-duanya mengekalkan aktivitinya.
250 mg, 500 mg serbuk untuk penyelesaian untuk suntikan, 1 g, 2 g serbuk untuk penyelesaian untuk suntikan atau infus
Persediaan untuk penyelesaian suntikan bolus
1. Masukkan jarum jarum suntik melalui penutup botol dan suntikan jumlah pengencer yang disyorkan. Ketiadaan udara dapat memudahkan pengencer masuk. Tanggalkan jarum jarum suntik.
2. Goncangkan untuk larut: Karbon dioksida dilepaskan dan larutan yang jelas akan diperoleh dalam 1-2 minit.
3. Putar botol. Dengan pelocok jarum suntik sepenuhnya diturunkan, masukkan jarum melalui bukaan botol dan tarik jumlah keseluruhan larutan ke dalam jarum suntik (tekanan di dalam botol boleh membantu aspirasi). Pastikan jarum berada di dalam larutan dan tidak memasuki ruang atas. Larutan yang dihirup mungkin mengandungi gelembung kecil karbon dioksida, ini boleh diabaikan.
Penyelesaian ini dapat diberikan secara langsung ke vena atau diperkenalkan melalui set infus jika pesakit menerima cairan secara parenteral. Ceftazidime serasi dengan cecair infus yang paling biasa digunakan.
1 g, 2 g serbuk untuk penyelesaian untuk suntikan atau infus
Persediaan untuk penyelesaian infus ceftazidime untuk suntikan dalam bekas standard (beg mini atau set infus jenis buret)
Sediakan larutan menggunakan pelarut serasi sebanyak 50 ml (untuk botol 1 g dan 2 g) tambahkannya dalam DUA langkah seperti berikut.
1. Masukkan jarum suntik melalui penutup botol dan suntikan 10 ml pelarut untuk botol 1 g dan 2 g.
2. Tarik jarum dan goncangkan botol untuk menjernihkan larutan.
3. Jangan masukkan jarum untuk mengeluarkan gas sehingga produk larut. Masukkan jarum untuk mengeluarkan gas melalui penutup botol untuk menghilangkan tekanan dalaman.
4. Pindahkan larutan yang dibentuk semula ke alat pentadbiran akhir (beg mini atau set infus jenis buret) menyediakan jumlah keseluruhan sekurang-kurangnya 50 ml dan berikan melalui infus intravena dalam jangka masa 15 hingga 30 minit.
Catatan: Untuk mengekalkan kemandulan produk, jarum untuk mengeluarkan gas tidak dimasukkan ke dalam bukaan botol sebelum produk larut.
1 g, 2 g serbuk untuk penyelesaian untuk infusi (dengan peranti Monovial)
Persediaan untuk penyelesaian untuk infus intravena
Kandungan Monovial ditambahkan ke dalam beg infus bervolume kecil yang mengandungi 0,9% natrium klorida atau larutan dekstrosa 5%, atau cairan infus lain yang serasi.
Monovial 2 g mesti disusun semula menggunakan beg infusi 100 ml.
1. Kupas bahagian atas label yang boleh ditanggalkan dan lepaskan penutup pelindung.
2. Masukkan jarum Monovial ke dalam port masuk beg infusi.
3. Untuk membenarkan penggunaan Monovial, tekan pelindung jarum plastik ke bahu botol sehingga anda terdengar bunyi klik.
4. Pegang botol dengan tegak dan isikan kira-kira dua pertiga penuh dengan memerah beg beberapa kali.
5. Goncangkan botol untuk membubarkan serbuk.
6. Fizikal sedikit akan timbul semasa penggabungan semula.
7. Dengan botol di atas, pindahkan ceftazidime yang disusun semula ke dalam beg infusi dengan memerah dan melepaskan beg.
8. Ulangi langkah 4 hingga 7 untuk membilas bahagian dalam botol. Buang Monovial kosong dengan selamat. Pastikan serbuk telah larut dan beg tidak bocor.
Ubat yang tidak digunakan dan sisa yang berasal dari ubat ini mesti dibuang sesuai dengan peraturan tempatan.
07.0 PEMEGANG KEBENARAN PEMASARAN
GlaxoSmithKline S.p.A. - Melalui A. Fleming 2, Verona.
08.0 NOMBOR KEBENARAN PEMASARAN
GLAZIDIM 250 mg Serbuk untuk penyelesaian untuk suntikan
A.I.C .: 025212010
GLAZIDIM 500 mg Serbuk untuk penyelesaian untuk suntikan
A.I.C .: 025212022
GLAZIDIM 1 g Serbuk untuk penyelesaian untuk suntikan
A.I.C .: 025212034
A.I.C .: 025212046
GLAZIDIM 1 g Serbuk untuk penyelesaian untuk suntikan atau infus
A.I.C .: 025212111 (pek 10 botol)
A.I.C .: 025212123 (kotak 25 botol)
GLAZIDIM 2 g Serbuk untuk penyelesaian untuk suntikan atau infus
A.I.C .: 025212059
GLAZIDIM 1 g Serbuk untuk penyelesaian untuk infusi dengan alat MONOVIAL
A.I.C .: 025212073
A.I.C .: 025212097 (dengan beg infusi)
GLAZIDIM 2 g Serbuk untuk penyelesaian untuk infusi dengan alat MONOVIAL
A.I.C .: 025212085
A.I.C .: 025212109 (dengan beg infusi)
09.0 TARIKH KEBENARAN ATAU PEMBAHARUAN KEBENARAN
10 Mac 1984 / Jun 2008
10 Disember 1996 / Jun 2008 (pek dengan peranti MONOVIAL)
10.0 TARIKH SEMAKAN TEKS
02 April 2015